貝達藥業(yè)腫瘤治療創(chuàng)新藥BPI-17509臨床試驗申請獲受理最先出現(xiàn)在碳中和產(chǎn)學(xué)研促進委員會。
]]>齊魯制藥領(lǐng)跑一致性評價,復(fù)星醫(yī)藥幾乎全為289品種
據(jù)藥智藥品注冊與受理數(shù)據(jù)庫統(tǒng)計,截止12月6日,CDE共受理一致性評價受理號580個,涉及221家企業(yè)的210個品種。其中引人注目的是,在所有申報一致性評價的企業(yè)當(dāng)中齊魯制藥無論是從受理號還是從品種數(shù)來看,都是申報最多的企業(yè),申報受理號達44個,品種數(shù)有25個,高居申報一致性評價申報企業(yè)榜首;其次為復(fù)星醫(yī)藥24個受理號14品種,值得提及的是復(fù)星醫(yī)藥申報的14個品種有13個為289目錄藥品;中國生物制藥也以23受理號18品種緊隨其后,其中正大天晴占19個受理號15個品種(包括南京正大天晴)。以下是申報一致性評價審報企業(yè)TOP10詳情:
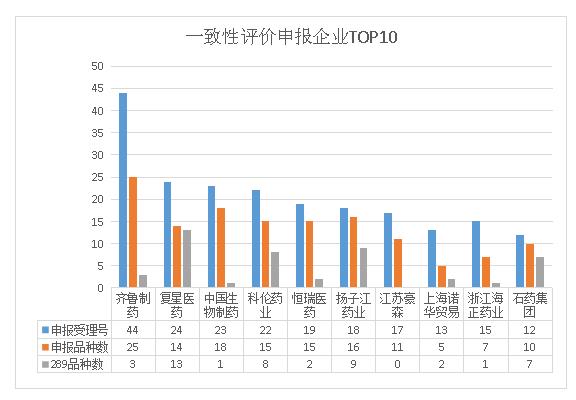
華海藥業(yè)一致性評價大贏家,石藥、揚子江、復(fù)星醫(yī)藥289過評最多
截止12月6日,共有126個受理號64個品種通過一致性評價(含視同通過),其中289目錄藥品有42個受理號21個品種過評,完成率僅7.27%。年關(guān)將至,各企業(yè)一致性評價工作通過情況如何?下面一起看看一致性評價通過較多的前5個企業(yè)詳情。
通過一致性評價企業(yè)TOP5
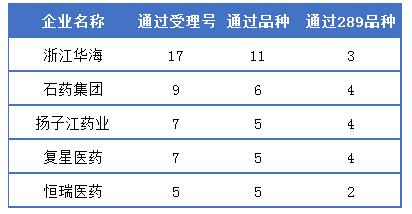
華海藥業(yè)通過一致性評價詳情
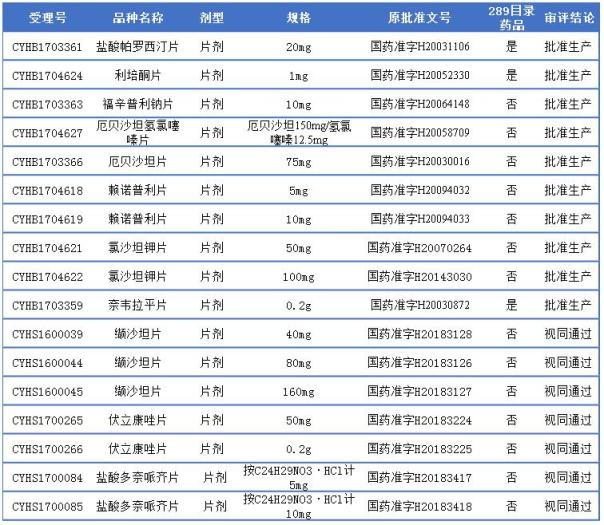
浙江華海藥業(yè)無疑是一致性評價的最大贏家,17受理號11品種過評。另據(jù)藥智藥品注冊與受理數(shù)據(jù)庫顯示,其中通過補充申請一致性評價受理號有10個,涉及8個品種,且為華海藥業(yè)申報的一致性評價所有藥品,目前全部過評,可謂百發(fā)百中;此外,還有7個受理號3品種,通過進入中國上市藥品目錄集,視同通過一致性評價;且在已過評的11品種中需要在今年年底完成的289目錄品種有3個,為鹽酸帕羅西汀片、利培酮片和奈韋拉平片,具體詳情可見下表:
華海藥業(yè)一致性評價獲批詳情表
除了華海藥業(yè),石藥集團、揚子江藥業(yè)、復(fù)星醫(yī)藥、恒瑞醫(yī)藥一致性評價也不甘落后,且值得提及的是石藥集團、揚子江藥業(yè)和復(fù)星醫(yī)藥盡管通過的品種數(shù)遠遠少于浙江華海藥業(yè),然而他們的289目錄藥品卻是所有企業(yè)通過最多的,均有4個品種過評,占據(jù)各自企業(yè)通過品種數(shù)量的大半。
石藥集團過評一致性評價詳情
石藥集團的一致性評價藥品主要來源于石藥歐意和石藥中諾,其中石藥歐意占5個,289目錄藥品有3個,為鹽酸二甲雙胍片、阿奇霉素片和卡托普利片;石藥中諾有1個,為289目錄藥品阿莫西林膠囊;詳情如下表:
石藥集團通過一致性評價詳情表

揚子江藥業(yè)過評一致性評價詳情
揚子江藥業(yè)5個過評品種當(dāng)中有4個藥品為289目錄藥品,為揚子江上海海尼藥業(yè)苯磺酸氨氯地平片、揚子江廣州海瑞藥業(yè)格列美脲片以及揚子江集團蒙脫石散和揚子江江蘇制藥馬來酸依那普利片,且其中馬來酸依那普利片和格列美脲片為首家過評品種,更多詳情可見下表:
揚子江一致性評價過評詳情表
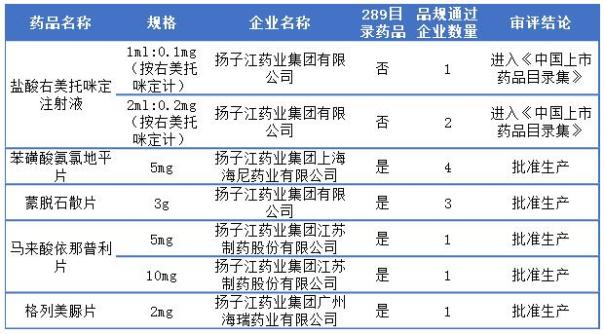
復(fù)星醫(yī)藥過評一致性評價詳情
復(fù)星醫(yī)藥一致性評價同石藥集團一樣,一致性評價藥品主要來源于旗下的子公司,且5個品種有4個為289目錄藥品,江蘇黃河的苯磺酸氨氯地平片、重慶藥友的阿法骨化醇片和鹽酸克林霉素膠囊以及蘇州二葉的阿奇霉素膠囊,且阿法骨化醇片和阿奇霉素膠囊目前為止僅有1家過評。更多詳情可見下表:
復(fù)星醫(yī)藥通過一致性評價詳情表
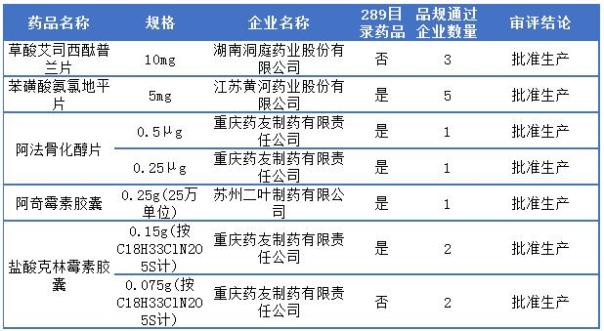
恒瑞醫(yī)藥一致性評價通過詳情
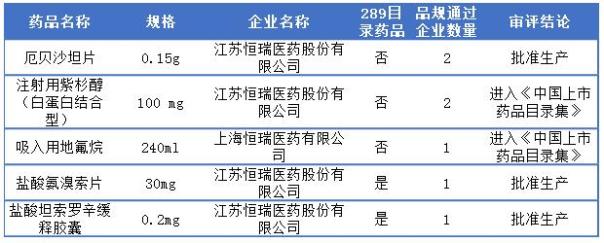
恒瑞醫(yī)藥截止目前一致性評價一共有5品種過評,其中江蘇恒瑞醫(yī)藥占4個,上海恒瑞醫(yī)藥僅1個,2個289目錄藥品為江蘇恒瑞的鹽酸氨溴索片和鹽酸坦索羅辛緩釋膠囊,更多詳情可見下表:
恒瑞醫(yī)藥通過一致性評價詳情表
貝達藥業(yè)腫瘤治療創(chuàng)新藥BPI-17509臨床試驗申請獲受理最先出現(xiàn)在碳中和產(chǎn)學(xué)研促進委員會。
]]>外媒:中國亟需培養(yǎng)年輕外科醫(yī)生 增加實踐性培訓(xùn)最先出現(xiàn)在碳中和產(chǎn)學(xué)研促進委員會。
]]>2015年6月,醫(yī)生告訴69歲的帥水清(音),她患上了胃癌,需要做手術(shù)。她來到位于成都的華西醫(yī)院。這家醫(yī)院是在中國最好的醫(yī)院之一。她在那里為了排一位外科醫(yī)生的手術(shù)等了6周。到接受手術(shù)時,她已經(jīng)陷入休克。外科大夫發(fā)現(xiàn),癌細胞已經(jīng)擴散到其他器官。她在一年后去世。
文章稱,很難說,早點做手術(shù)是否會拯救帥水清的性命。但她的例子揭示了中國一個越來越嚴(yán)重的問題,即病人對醫(yī)療的需求遠遠超過中國提供醫(yī)療的能力。病人往往要冒著風(fēng)險等待很長時間才能接受手術(shù)。這不是因為中國缺乏外科大夫,而是因為實際上能做手術(shù)的外科大夫人數(shù)不足。世界銀行的數(shù)據(jù)顯示,中國人均擁有的外科醫(yī)生數(shù)量同其他中高收入國家相同,但總體來說,中國外科醫(yī)生進行的手術(shù)比其他國家外科醫(yī)生少40%。
手術(shù)產(chǎn)出為什么這么低?一個原因是親身實踐的培訓(xùn)太少,當(dāng)中國的外科醫(yī)生完成手術(shù)培訓(xùn),很多人很少有機會做手術(shù)。培訓(xùn)后,他們可能會花很多年協(xié)助資深的外科大夫或從事一些簡單治療。2016年,中山大學(xué)的一些中國公共衛(wèi)生專家在英國《柳葉刀》周刊上撰文說,在中國,不足5%的手術(shù)是由43歲以下的醫(yī)生完成的。他們寫道:“今天中國各個層次的外科受訓(xùn)人員面臨的最大挑戰(zhàn)是親身學(xué)習(xí)的機會太少。”
文章稱,作為一名研究中國外科教育的美國醫(yī)學(xué)生,馬貢曾經(jīng)在中國的時候已經(jīng)了解了上述數(shù)據(jù)。美國體系有著“看一個、做一個、教一個”的風(fēng)氣,在美國,醫(yī)學(xué)教育工作對醫(yī)生來說是最受尊敬的就業(yè)形式。所以,當(dāng)馬貢來到中國,看到中國學(xué)術(shù)性醫(yī)學(xué)中心里實踐性教學(xué)之少依然讓他吃驚。馬貢發(fā)現(xiàn),年輕外科醫(yī)生通常要花數(shù)十年才能等到機會停止旁觀、開始做手術(shù)。在美國,在一定安全和實踐約束之下,外科醫(yī)生會給予受訓(xùn)者最大的自主權(quán)。
在中國,有關(guān)的學(xué)習(xí)被推遲了。舉北京一家一流醫(yī)院的一名眼科醫(yī)師的情況為例。獲得碩士和博士學(xué)位后,她完成了一個醫(yī)生實習(xí)項目。現(xiàn)在是一個著名眼科醫(yī)院的眼科主治醫(yī)生。除了她繁忙的培訓(xùn)計劃,她還設(shè)法發(fā)表了數(shù)十篇同行評議的研究論文。我問她做過多少臺白內(nèi)障手術(shù)。她說:“一臺也沒有。我看了很多臺手術(shù),但從來沒有操作過。”她這個職業(yè)階段的美國眼科醫(yī)生就算沒有做過數(shù)百臺這類手術(shù),也做過幾十臺了。
由于很多外科醫(yī)生只能在職業(yè)中期之后從事手術(shù),這個體系制造的瓶頸會影響對病人的護理。例如,在中國,一半的失明病例源于沒有接受白內(nèi)障手術(shù),但卻只有36%的中國眼科醫(yī)生可以做手術(shù)。結(jié)果,中國人均白內(nèi)障手術(shù)率比資源較貧乏的越南和印度還低很多,比起美國就更低得多。在美國,不足15%的失明病例源于白內(nèi)障。
文章稱,高水平的外科醫(yī)生常常集中在大型醫(yī)學(xué)中心,這導(dǎo)致小醫(yī)院缺乏有經(jīng)驗的醫(yī)生,而大醫(yī)院擠滿了尋求專業(yè)醫(yī)療的病人。北京協(xié)和醫(yī)學(xué)院的婦產(chǎn)科醫(yī)師龔曉明(音)說,這種情況導(dǎo)致一些鄉(xiāng)村病人冬天在寒冷的北京排隊等待幾天,只為做一個簡單的檢查。
外媒:中國亟需培養(yǎng)年輕外科醫(yī)生 增加實踐性培訓(xùn)最先出現(xiàn)在碳中和產(chǎn)學(xué)研促進委員會。
]]>吉大教授朱迅:制藥行業(yè)商業(yè)模式將改變 “產(chǎn)品為王”時代到來最先出現(xiàn)在碳中和產(chǎn)學(xué)研促進委員會。
]]>
吉林大學(xué)教授、同寫意新藥英才俱樂部理事長朱迅圖片來源:每日經(jīng)濟新聞
今日(12月3日)下午,由每日經(jīng)濟新聞主辦的“2018中國醫(yī)藥資本論壇”在廣州舉行,吉林大學(xué)教授、同寫意新藥英才俱樂部理事長朱迅出席論壇并發(fā)表了“醫(yī)藥崛起,來自每一次改革——新藥研發(fā)的中國機會”主旨演講。
朱迅提到,我國醫(yī)藥行業(yè)正在經(jīng)歷的監(jiān)管政策調(diào)整,不是一次局部的或者階段性的調(diào)整,而是一場全方位的變革,變革目的是重構(gòu)。眼下,我國的監(jiān)管政策正在向國際通用規(guī)則靠近,這將徹底改變我國制藥行業(yè)的商業(yè)模式。商業(yè)模式的變化之一就是制藥公司及藥品品種的格局將發(fā)生重塑,從銷售主導(dǎo)走向產(chǎn)品主導(dǎo),“產(chǎn)品為王”的時代正在到來。
朱迅表示,我國醫(yī)藥行業(yè)藥品低門檻的時代即將結(jié)束,“今天我國大量的制藥公司,在十年后可能將不復(fù)存在。強者恒強、弱者離場的局面即將到來。”
吉大教授朱迅:制藥行業(yè)商業(yè)模式將改變 “產(chǎn)品為王”時代到來最先出現(xiàn)在碳中和產(chǎn)學(xué)研促進委員會。
]]>我國自主研發(fā)第三代人工心臟下月將進入臨床試驗階段最先出現(xiàn)在碳中和產(chǎn)學(xué)研促進委員會。
]]>人工心臟需求量大
心血管疾病已經(jīng)成為國民第一位死亡原因,全國心血管疾病患者高達2.9億。每年大約有370萬人死于心血管疾病。目前心血管疾病的治療方式主要有藥物治療,外科手術(shù)治療和介入治療。心力衰竭患者以往只能等待心臟移植,而器官移植等待期往往較長,人工心臟的出現(xiàn)猶如“及時雨”,能幫助患者延長壽命。
中國醫(yī)學(xué)科學(xué)院阜外醫(yī)院再生醫(yī)學(xué)重點實驗室副主任周建業(yè)教授介紹,人工心臟分為輔助人工心臟和全人工心臟,我國所說的人工心臟是輔助人工心臟。其應(yīng)用主要有三類,包括給等待心臟移植供體的患者提供過渡的時間和支持;或用于逆轉(zhuǎn)心臟重構(gòu)、恢復(fù)患者心臟功能;或為患者提供終生的心臟輔助。從2006年6月至2018年7月,已經(jīng)有近2.5萬人使用了輔助人工心臟,尤其是2013年以來,每年都會在2500人以上,需求很大。但是,人工心臟動輒上百萬元的費用也讓不少人為之咋舌。
對此,胡盛壽強調(diào),只有發(fā)展國產(chǎn)人工心臟,才能降低治療費用。這也使得人工心臟研發(fā)成為心血管研發(fā)中非常重要的領(lǐng)域。而且人工心臟研發(fā)是所有心血管醫(yī)療器械研發(fā)中含金量最高、研發(fā)周期較長、需要多個學(xué)科共同參與的領(lǐng)域。
我國七個單位在研發(fā)人工心臟當(dāng)前醫(yī)療器械是我國大健康領(lǐng)域創(chuàng)新最活躍、發(fā)展最強勁、動力最充足的產(chǎn)業(yè)之一。在國家各個方面的支持下,我國醫(yī)療器械創(chuàng)新能力有了顯著提升,新技術(shù)新產(chǎn)品也層出不窮,這其中就包括了人工心臟的研發(fā)。
周建業(yè)介紹,我國有七個單位在研發(fā)人工心臟,包括一代、二代和三代。新京報記者查詢資料發(fā)現(xiàn),重慶永仁心醫(yī)療器械有限公司的離心泵型人工心臟技術(shù)由日本研發(fā),是首個在中國獲批臨床試驗的人工心臟,已經(jīng)完成11例注冊臨床試驗。由天津市蘭德投資有限公司和山西省長治市久安人工心臟科技開發(fā)有限公司共同研制的軸流泵型人工心臟也已經(jīng)完成了5例臨床試驗,同樣是我國自主研發(fā)的人工心臟。而即將開始臨床試驗的是第三代全磁懸浮離心泵人工心臟,由江蘇同心醫(yī)療器械有限責(zé)任公司研發(fā)。
新京報記者從到會的江蘇同心工作人員處得到確認,目前人工心臟臨床試驗審批正在進行倫理審查,預(yù)計下周拿到臨床試驗批件,下月可以進入臨床試驗。胡盛壽介紹,該款人工心臟所有技術(shù)參數(shù)均達到了全球最先進的磁懸浮人工心臟技術(shù)指標(biāo),甚至有些方面更為優(yōu)秀,比如體積更小、重量更輕。
除此之外,還有航天18所與天津泰達醫(yī)院、深圳核心醫(yī)療科技有限公司也在分別研發(fā)第三代人工心臟。前者仍在注冊檢驗階段,后者則處在樣機研發(fā)階段。
我國自主研發(fā)第三代人工心臟下月將進入臨床試驗階段最先出現(xiàn)在碳中和產(chǎn)學(xué)研促進委員會。
]]>衛(wèi)健委發(fā)文敦促公立醫(yī)院抓緊開展網(wǎng)絡(luò)支付業(yè)務(wù)最先出現(xiàn)在碳中和產(chǎn)學(xué)研促進委員會。
]]>
“有條件的地方可以探索區(qū)域共享網(wǎng)絡(luò)支付平臺建設(shè)。通過提供更加便捷的支付結(jié)算服務(wù),優(yōu)化就診流程,提高工作效率,提升服務(wù)質(zhì)量。”近日,國家衛(wèi)生健康委辦公廳印發(fā)《關(guān)于印發(fā)公立醫(yī)院開展網(wǎng)絡(luò)支付業(yè)務(wù)指導(dǎo)意見的通知》,以指導(dǎo)公立醫(yī)院開展網(wǎng)絡(luò)支付業(yè)務(wù),進一步改善患者就醫(yī)體驗。
《通知》提出,要構(gòu)建科學(xué)規(guī)范的網(wǎng)絡(luò)支付管理運行機制。首先要嚴(yán)格賬戶和資金管理。醫(yī)院財務(wù)部門統(tǒng)一負責(zé)網(wǎng)絡(luò)支付結(jié)算銀行賬戶使用和管理,切實履行資金存放管理責(zé)任,加強賬戶資金管理,保障資金安全。用于網(wǎng)絡(luò)支付業(yè)務(wù)結(jié)算的銀行賬戶,應(yīng)當(dāng)是以單位名義開設(shè)的銀行賬戶,賬戶的開立和使用符合財政部門、中國人民銀行和國家衛(wèi)生健康委賬戶管理有關(guān)規(guī)定。
第二是要規(guī)范對賬和結(jié)算管理制度。醫(yī)院應(yīng)當(dāng)每日對網(wǎng)絡(luò)支付業(yè)務(wù)的賬務(wù)進行核對。如有差異,要及時查明原因,及時處理,確保醫(yī)院信息系統(tǒng)、銀行結(jié)算賬戶賬款保持一致。對于發(fā)生單邊賬項的情況,醫(yī)院應(yīng)當(dāng)明確處理流程,核實交易的真實性,確認交易最終完成后,再進行相應(yīng)業(yè)務(wù)操作和賬務(wù)處理。
此外還在強化退費管理制度、建立檔案管理制度、完善信息系統(tǒng)管理制度、健全內(nèi)部控制制度等方面提出了相應(yīng)的建議和要求。
《通知》尤其指出要周密做好網(wǎng)絡(luò)支付業(yè)務(wù)開展前的評估論證。首先要對運用網(wǎng)絡(luò)支付業(yè)務(wù)的可行性進行充分論證。醫(yī)院在全面開展網(wǎng)絡(luò)支付業(yè)務(wù)前,應(yīng)當(dāng)結(jié)合自身實際情況,組織相關(guān)專家及技術(shù)人員論證選用商業(yè)銀行或非銀行支付機構(gòu)(以下簡稱支付機構(gòu))的信息平臺是否能與現(xiàn)行的醫(yī)院信息系統(tǒng)相融合,評估醫(yī)院信息系統(tǒng)運行維護、安全技術(shù)防護等級是否達標(biāo)等,充分考慮自身風(fēng)險承受能力。
其次,要對合作機構(gòu)資質(zhì)嚴(yán)格審核。醫(yī)院應(yīng)當(dāng)嚴(yán)格審核合作商業(yè)銀行或支付機構(gòu)資質(zhì),依據(jù)相關(guān)法律法規(guī)選定合作機構(gòu)。在與支付機構(gòu)合作時,應(yīng)當(dāng)對其《支付業(yè)務(wù)許可證》的許可范圍和有效期限進行查驗,并且優(yōu)先選擇資質(zhì)高、實力強、信譽好的機構(gòu)。
此外,還要明確相關(guān)責(zé)任。醫(yī)院應(yīng)當(dāng)重視網(wǎng)絡(luò)支付業(yè)務(wù)的合同管理,組織法律、信息技術(shù)、財會、醫(yī)務(wù)等人員參與網(wǎng)絡(luò)支付服務(wù)的談判及合同訂立,應(yīng)當(dāng)就收單銀行結(jié)算賬戶的設(shè)置和變更、資金結(jié)算周期、結(jié)算手續(xù)費標(biāo)準(zhǔn)、差錯和爭議處理等事項,與支付機構(gòu)、商業(yè)銀行明確權(quán)利、義務(wù)和違約責(zé)任。對于開通支付平臺公眾服務(wù)窗的情況,由于其中預(yù)約掛號、報告查詢、線上繳費等功能涉及患者信息和醫(yī)院業(yè)務(wù)數(shù)據(jù)等,應(yīng)當(dāng)要求服務(wù)商禁止以任何形式對外提供患者的身份及診療信息。
《通知》還強調(diào)要在加強對公立醫(yī)院開展網(wǎng)絡(luò)支付業(yè)務(wù)的指導(dǎo)、研究推行電子醫(yī)療收費票據(jù)的措施、協(xié)調(diào)推進網(wǎng)絡(luò)支付與醫(yī)保結(jié)算的對接等方面提出要求,以加強網(wǎng)絡(luò)支付業(yè)務(wù)開展后的業(yè)務(wù)指導(dǎo)和監(jiān)督管理工作。
衛(wèi)健委發(fā)文敦促公立醫(yī)院抓緊開展網(wǎng)絡(luò)支付業(yè)務(wù)最先出現(xiàn)在碳中和產(chǎn)學(xué)研促進委員會。
]]>讓假藥“無處躲藏” 我國將建立藥品全程追溯體系最先出現(xiàn)在碳中和產(chǎn)學(xué)研促進委員會。
]]>6月8日,齊齊哈爾市相關(guān)部門在聯(lián)合檢查中發(fā)現(xiàn)訥河市某藥店出售假藥“舒筋健腰丸”,接著又陸續(xù)在依安縣、甘南縣、克山縣等地多處藥店、診所查獲大量假藥。
此案件引起了公安部及最高檢的高度重視。由此,一場打擊假藥的行動由此展開。此次案件中,公安部迅速成立“6·8”專案組督辦此案,而最高檢也將其列為掛牌督辦的案件。在河南、黑龍江兩省公安機關(guān)的配合下,李某和另外4個制假團伙被抓獲歸案,13個銷售假藥犯罪團伙也落入法網(wǎng)。
據(jù)了解,公安機關(guān)在此案中扣押的假藥多達幾百種,“功效”龐雜且大都冒充的是常用藥品,包裝、使用說明書都與真藥無二,大多在正規(guī)藥店、診所出售。
著名醫(yī)改專家魏子檸在接受《中國產(chǎn)經(jīng)新聞》記者采訪時認為,當(dāng)前,大量假藥不僅流入了網(wǎng)上、農(nóng)村,甚至還流入了正規(guī)的藥店。監(jiān)管層在這方面的監(jiān)管其實難度是比較大的,同時,其監(jiān)管也相對薄弱些。
監(jiān)管力度逐步加大
山東日照市某鄉(xiāng)鎮(zhèn)的王女士前不久剛剛做完心臟手術(shù)。王女士的女兒劉然(化名)告訴《中國產(chǎn)經(jīng)新聞》記者,她的母親是做第二次心臟支架,第一次做的時候是在幾年前做的,因種種因素,那時候她的母親沒有醫(yī)保,所以心臟支架全部是自費花了十多萬元,而這一次做支架因為這邊的農(nóng)村也納入到了醫(yī)保,所以這次做心臟手術(shù)只花了7萬元。
“一般老人家類似這種大病才能到市里看病,但是平時家人有個頭疼腦熱的(指的是感冒、頭疼等一些小病種)就不可能到市里的大醫(yī)院打針或者開藥,都是在村里的診所拿點藥。但目前有個問題是,村里診所的藥感覺不太對勁。”劉然說,有一次,她父親得了急性胃炎,就到診所拿了點藥吃,但吃后止痛的效果并不明顯,后來又給她打電話,她從市里的藥房開了同樣廠家及一樣品牌的藥,父親吃完她在市里買的藥后,疼痛也止住了,所以她懷疑村里的小診所賣的有可能是假藥。
前不久,據(jù)央視新聞頻道報道稱,江西警方破獲了一起售賣假藥的案件,現(xiàn)場一卡車一卡車的假藥運輸回來,其中,包括孕婦所服用的葉酸,老人用的風(fēng)濕膠囊等,光現(xiàn)場查獲的假藥和原料就有整整6噸多,賺取受害者資金超過1400多萬元。
該新聞還報道稱,今年1月30日,江西吉水縣公安局治安大隊聯(lián)合縣市場監(jiān)督管理局在吉水縣文峰鎮(zhèn)某診所內(nèi)查獲了金易通丸、風(fēng)濕骨友靈、特效筋骨康等藥品,經(jīng)過檢測均屬假藥。
藥品出現(xiàn)問題的不僅僅上述兩列,最近的一次問題藥品曝光來源于國家藥監(jiān)局的一則通報。據(jù)國家藥品監(jiān)督管理局通報顯示,根據(jù)線索,該局組織對長春長生生物科技有限責(zé)任公司開展飛行檢查,發(fā)現(xiàn)該企業(yè)“凍干人用狂犬病疫苗”生產(chǎn)存在記錄造假等嚴(yán)重違法違規(guī)行為。
記者在梳理資料時也了解到,雖然長春長生生物科技有限責(zé)任公司生產(chǎn)的“凍干人用狂犬病疫苗”存在問題,但幸運的是,本次飛行檢查所有涉事批次產(chǎn)品尚未出廠和上市銷售,全部產(chǎn)品已得到有效控制。
魏子檸說,近些年來,監(jiān)管層對于假藥、劣質(zhì)藥的打擊力度越來越大,而藥品管理法對生產(chǎn)、銷售假藥和劣質(zhì)藥的監(jiān)管是有明確規(guī)定的,并且處罰力度也在逐步提高。
據(jù)了解,針對此次長春長生生物科技有限責(zé)任公司的違法違規(guī)行為,國家藥監(jiān)局和吉林省食藥監(jiān)局分別對公司全資子公司作出了多項行政處罰共計91億元。
去疴的“猛藥良方”
事實上,監(jiān)管層在查處假藥、劣質(zhì)藥或有問題的假藥背后,也暴露出我國在藥品安全監(jiān)管領(lǐng)域還存在不少漏洞。近些年來,一些制藥企業(yè)及個人為了獲取暴利,導(dǎo)致藥品安全質(zhì)量問題及造假的案例頻發(fā)。不過,值得欣喜的是,對于吉林長春長生公司的問題疫苗案件發(fā)生后,也引起了中央政府的高度重視,由此也進一步影響了藥品管理修正法的修訂進程。稍早之前,記者在全國人大常委會公布的2018年度的全國人大常委會立法工作計劃中注意到,藥品管理法修正案并不在其中。
國家藥監(jiān)局局長焦紅指出,吉林長春長生公司問題疫苗案件發(fā)生后,習(xí)近平總書記作出重要指示,要求立即調(diào)查事實真相,一查到底,嚴(yán)肅問責(zé),依法從嚴(yán)處理,強調(diào)要始終把人民群眾的身體健康放在首位,以猛藥去疴、刮骨療毒的決心,完善我國疫苗管理體制。 10月22日召開的第十三屆全國人大常委會第六次會議上,國務(wù)院就提請審議《中華人民共和國藥品管理法(修正草案)》(以下簡稱:修正草案),擬針對問題疫苗案件暴露出的突出問題,對實施藥品上市許可持有人制度和推進審批制度改革以及藥品監(jiān)管制度等方面進行了修改。
據(jù)了解,修正草案擬從四方面加大對違法行為的處罰力度,解決違法成本低、處罰力度弱的問題。一是全面加大對違法行為的行政處罰力度。二是落實“處罰到人”要求,對嚴(yán)重違法行為的責(zé)任人進行處罰。三是結(jié)合本次修法相應(yīng)補充了藥品上市許可持有人的法律責(zé)任以及違法報告、召回等新設(shè)義務(wù)的法律責(zé)任。四是細化并加重對地方政府負責(zé)人和監(jiān)管人員的處分,對隱瞞、謊報、緩報藥品安全事故等行為規(guī)定了嚴(yán)格的處分。在疫苗方面,修正草案不僅強化了對疫苗的監(jiān)管,還提出了新的規(guī)定。例如,擬明確規(guī)定疫苗、血液制品、麻醉藥品、精神藥品、醫(yī)療用毒性藥品不得委托生產(chǎn)。不過,國務(wù)院藥品監(jiān)督管理部門規(guī)定可以委托生產(chǎn)的情形除外。
“修正草案中明確要求藥品供應(yīng)與保障,對藥品的研發(fā)、生產(chǎn)、流通、使用、評價、監(jiān)管等,體現(xiàn)了國家對藥品進行全過程監(jiān)管的治理思路。”魏子檸表示,把建立健全以市場需求為導(dǎo)向的藥品審評審批制度,鼓勵研究和創(chuàng)制新藥等寫入了這部法律,更加體現(xiàn)了國家在研發(fā)創(chuàng)新藥品的力度。這部法律如正式發(fā)布后,將給各類藥企和機構(gòu)戴上“緊箍咒”。例如,企業(yè)的研發(fā)創(chuàng)新,轉(zhuǎn)型升級以及藥品質(zhì)量都會得到改善,從法律層面上講,這部法律可以保障藥品質(zhì)量,讓群眾吃上“定心丸”。
讓假藥“無處躲藏” 我國將建立藥品全程追溯體系最先出現(xiàn)在碳中和產(chǎn)學(xué)研促進委員會。
]]>